近日,开云app网站生命科学学院博士后郭媛婷及其合作者在蝙蝠抗冠状病毒的起源机制方面取得新进展。
该研究成果近日以“Pleiotropy of positive selection in ancient ACE2 suggests an alternative hypothesis for bat-specific adaptations to host coronaviruses”为题发表在PNAS《美国科学院院报》期刊上。

血管紧张素转化酶(ACE2)是新冠病毒SARS-CoV-2侵入细胞的主要受体,而它原本的功能主要起到调节心率和血压的作用。而有趣的是,ACE2两种功能之间存在着紧密联系,例如,SARS-CoV-2感染的仓鼠和新冠重症患者通常都会出现心脏损伤,如心律失常、心力衰竭等。
蝙蝠是哺乳动物中唯一能真正飞行的类群,同时也被称为“天然病毒库”。它们演化出了一系列与ACE2两个功能都密切相关的适应性表型。一方面,飞行能力的起源和演化促使蝙蝠的心脏功能变强,心率调控能力增加。另一方面,尽管携带了多种可以引起人类传染病的冠状病毒,但是蝙蝠自身很少或不会表现出患病的明显症状。这些现象提示着,蝙蝠共同祖先ACE2可能经历了自然选择作用,影响了与蝙蝠飞行和抗冠状病毒相关的两种功能。
为了验证上述假说,研究团队检测了蝙蝠祖先枝系上ACE2的选择压力情况,发现蝙蝠祖先ACE2(AncBat-ACE2)确实存在显著的正选择信号,并且鉴定出了10个受到正选择的氨基酸位点。为了验证这些正选择位点的功能效应,研究团队通过重建蝙蝠祖先的ACE2蛋白,以及改变祖先序列中的正选择位点的突变体(AncBat-ACE2-mut)进行实验,结果发现,与突变体(AncBat-ACE2-mut)相比,蝙蝠祖先ACE2(AncBat-ACE2)具有显著更强的酶活性。
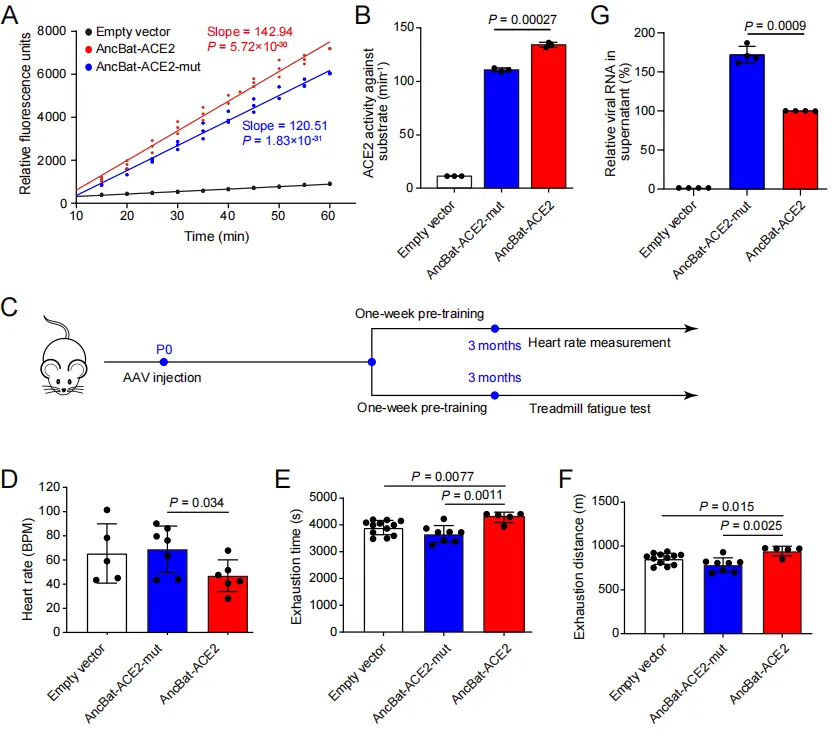
同时,研究团队进一步验证ACE2在蝙蝠祖先枝系上所受选择压力对心脏功能的影响,利用心脏特异表达的腺相关病毒(AAV9)分别将AncBat-ACE2和AncBat-ACE2-mut转染至小鼠心脏中,并对这些小鼠进行运动疲劳测试。发现携带AncBat-ACE2的小鼠比携带AncBat-ACE2-mut的小鼠的心率调节能力和运动能力都显著更强。
研究团队进一步利用感染实验分别检测了AncBat-ACE2和AncBat-ACE2-mut与新冠病毒SARS-CoV-2的亲和性,发现相较于AncBat-ACE2-mut,AncBat-ACE2与SARS-CoV-2的亲和力显著更低。
研究表明,自然选择对蝙蝠祖先ACE2两种功能造成了影响,提示着蝙蝠的飞行演化与抗冠状病毒之间的协同演化关系,该结果为蝙蝠如何进化出防御冠状病毒的机制提供了新的理解。
郭媛婷、中国科学院昆明动物研究所蒋继滨以及昆明医科大学乔冠荣为论文共同第一作者。中国科学院昆明动物研究所刘振研究员和昆明医科大学郑昌博副教授为论文通讯作者。 开云app网站为第一单位。
郭媛婷目前在开云app网站生命科学学院齐晓光教授团队从事灵长类行为与进化基因组学等方面的研究。
原文链接:http://www.sxjybk.com/2024/0702/93403.html?isShare=true